É um problema recorrente estas fórmulas de sabão de óleo usado que se encontram na internet. A atitude de reaproveitar o óleo usado de frituras para fazer sabão é louvável, a natureza agradece, e muitas vezes é uma renda suplementar de muitas famílias e de ONG.
A maioria das fórmulas que estão disponibilizadas tem um excesso muito grande de soda, tornando o produto perigoso. Vamos pegar como exemplo este video que foi colocado num post do grupo Saboaria:
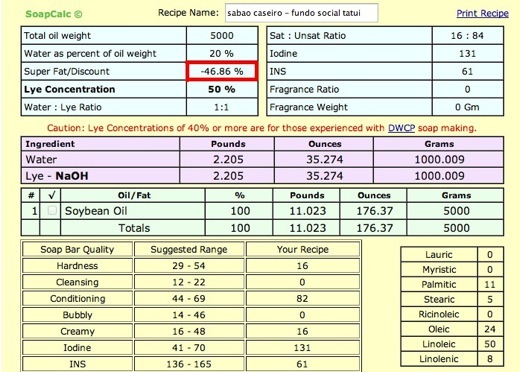
Esta fórmula do vídeo tem um excesso brutal de 46,8% de soda, tornando este sabão inseguro para o uso, vai atacar a pele das mãos e se for usado para lavar roupas, vai acabar com o tecido, diminuindo sua vida útil.
É incrível como as pessoas e instituições desconhecem um simples cálculo de saponificação, o cálculo para determinar a quantidade de soda necessária para fazer o sabão. Tenho atendido muitas solicitações de pessoas e notadamente de ONG que tem sua fábrica de sabão que os clientes reclamam da agressividade do sabão e inclusive os próprios operadores destas pequenas fábricas também reclamam do manuseio do sabão durante o processo. que queimam a pele e destroem as roupas.
A Anvisa (orgão regulamentador no Brasil) estabelece para um sabão o máximo de pH de 10 e o controle da alcalinidade é feita pela determinação do teor de óxido de sódio que deve se no máximo de 1%.
Um professor que estava montando um projeto para uma ONG no estado do Espírito Santo me procurou dizendo que nao conseguia atender as especificações da Anvisa, seu pH era de 12,4 e o teor de óxido de sódio estava em 2,4%, muito superior ao máximo permitido de 1%. Analisando a fórmula, estava com um excesso de 28% de soda!
Imagina essa fórmula do vídeo, deve estar com pH de 13 e teor de óxido de sódio de pelo menos 4%.
O cálculo para saber a quantidade de soda (pureza mínima de 97%) é simples e elementar. Não importa qual óleo usado que você vai usar, o normal é vc coletar óleo de fritura de uso doméstico e esse invariavelmente vai ser, soja, canola, oliva ou girassol. Pois bem, o índice de saponificação (determina a quantidade de soda necessária para reagir com o óleo) destes óleos são muito semelhantes: 0,136, 0,133, 0,135 e 0,135g de soda para cada grama de óleo, respectivamente.
Podemos utilizar o valor de 0,136g para todos estes óleos e as suas misturas, independente da composição da mistura.
O cálculo é assim: quantidade de óleo em gramas x 0,136 = quantidade de soda necessária.
No caso da fórmula do video ficaria: 5000g x 0,136 = 680g de soda. Para essa quantidade de óleo de 5Kg está sendo usado 1kg de soda e daí o excesso perigoso de 46,8%. Para esses 1 kg de soda seriam necessários: 1000g/0,136g = 7353g de óleo.
A quantidade de água para diluir a soda, para fazer a solução de soda, pode variar de 30 a 50%, sendo que nas concentrações mais elevadas, por ter menos água, o sabão endurece e seca mais rápido e a reação de saponificação é tb mais rápida.
Na fórmula do video a concentração está a 50% (1kg de água para 1kg de soda).
Voces podem observar que a senhora diz, ingenuamente, que o sabão dela à medida que vai secando vai se tornando mais branco! O excesso de soda é tão grande que à medida que envelhece, vai se formando a “soda ash”, a cinza branca da soda que nada mais é do que a reação da soda superficial com o gás carbonico da atmosfera, formando o carbonato de sódio, branco.
O álcool é solvente do sabão e portanto neste caso vai acelerar a formação do traço, mas isso é agregar custos desnecessário, pois uma agitação vigorosa e prolongada tem o mesmo efeito.
Se preferirem pode ser usado uma calculadora de sabão para fazer os cálculos, como nesse caso com o Soapcalc: